Аммиак: важный, но опасный газ
Продукт оазиса Аммона
Аммиак (в европейских языках его название звучит как «аммониак») обязан своим названием оазису Аммона в Северной Африке, располагавшемуся на перекрестке караванных маршрутов.
В жарком климате мочевина (NH2)2CO, содержащаяся, как можно понять из названия, в продуктах жизнедеятельности животных, разлагается особенно быстро и не может не привлечь внимание к себе: одним из продуктов разложения и является газообразное вещество, придающее моче ее характерный запах.
По другой версии, аммиак получил свое название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали минерал нашатырь (NH4Cl), который при нагревании испаряет аммиак.
Итак, в природных условиях аммиак - это бесцветный газ с формулой NH3. Плотность аммиака почти вдвое меньше, чем плотность воздуха, чем объясняется чрезвычайная летучесть этого вещества.
Аммиак отлично растворим в воде: на один условный объем воды может приходиться до 1200 объемов аммиака (при температуре воды 0 °C) или до 700 объемов (при 20 °C).
Раствор аммиака в воде - это всем известный нашатырный спирт, который применяется в медицине в качестве органолептического раздражителя: его, дают «понюхать» потерявшему сознание - это позволяет возбудить дыхание и вывести человека из обморочного состояния. Еще одна область бытового применения аммиака - садоводство и огородничество, а также выращивание комнатных растений, где раствор аммиака применяется для подкормок и как защитное инсектицидное средство.

Нашатырный спирт, он же 10% раствор аммиака (фото: poslov.com)
Помимо газообразного состояния, аммиак может иметь твердое (в виде кристаллов) и жидкое (не путать с нашатырным спиртом) состояние – в таком виде это вещество и выпускается промышленностью.
Аммиак в живой природе
Аммиак играет огромную роль и в живой природе. Причем если растениям аммиак нужен на «входе» как источник азота, то для животных организмов аммиак - продукт метаболизма.
Давайте вкратце разберемся, как работают эти механизмы.
Несмотря на то, что азот - один из самых распространенных на Земле химических элементов, из него на 75 % состоит атмосферный воздух, очень мало живых существ способно потреблять нейтральный двухатомный азот атмосферы.
Поэтому для включения азота атмосферы в биологический оборот, в частности, в синтез аминокислот и нуклеотидов, необходим процесс, который называется азотфиксацией.
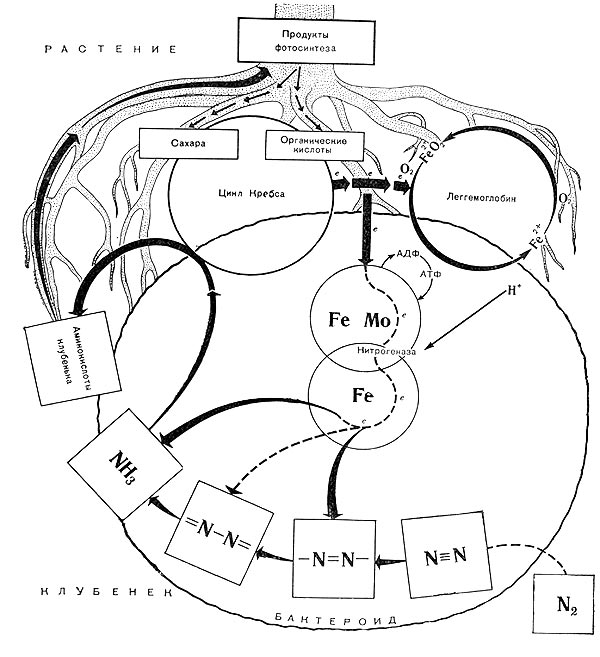
Механизм фиксации молекулярного азота (картинка: studopedia.ru)
И если некоторые растения, такие, как, например, бобовые, используют симбиоз с азотфиксирующими бактериями (ризобиями), которые синтезируют аммиак из воздуха с помощью ферментов, называемых нитрогеназами, то другие растения напрямую зависят от доступности аммиака (а также других нитрогенных соединений), непосредственно образующихся в почве в результате разложения органических остатков.
Полученный такими способами азот идет на построение белков и нуклеотидов.
В животном мире аммиак является, в основном, конечным побочным продуктом метаболизма аминокислот - а именно результатом их дезаминирования при помощи таких ферментов, как глутамат-дегидрогеназа.
Выведение аммиака из животных организмов осуществляется в разных формах. Если рыбы и водные беспозвоночные выделяют аммиак в неизмененном виде, то у млекопитающих, включая человека, аммиак сначала превращается в мочевину, которая гораздо менее токсична и имеет меньшую щелочную реакцию (мочевина, в свою очередь, составляет основной компонент сухого остатка мочи).
Большинство птиц, пресмыкающихся, насекомых, паукообразных, однако, выделяют в качестве основного нитрогенного остатка не мочевину, а мочевую кислоту.
Как научились синтезировать «щелочной воздух»
Аммиак был впервые выделен в чистом виде английским естествоиспытателем Джозефом Пристли в 1774 году, который назвал его «щелочным воздухом» (англ. alkaline air).
Только 1785 году французский химик Клод Луи Бертолле установил точный химический состав аммиака. С этого времени в мире начались эксперименты по получению «щелочного воздуха» из азота и водорода. Дело в том, что аммиак был очень нужен для синтеза соединений азота, поскольку получение их из чилийской селитры ограничивалось постепенным истощением запасов последней.
Проблема уменьшения запасов селитры обострилась к концу XIX века, когда сельское хозяйство стало все больше переходить на рельсы интесификации, для чего требовалось большое количество удобрений – на природное плодородие земель в Европе в те годы уже никто не полагался.
Но только в начале XX века удалось изобрести технологию синтеза аммиака, пригодную для промышленности того времени. Прорыв осуществил немецкий химик Фриц Габер, начавший работать над этой задачей в 1904 году и к 1909 году создавший небольшой аппарат, в котором использовалось повышенное давление (в соответствии с принципом Ле-Шателье) и катализатор из осмия.
2 июля 1909 года Габер устроил испытания аппарата в присутствии представителей Баденского анилинового и содового завода фирмы BASF, и получил аммиак. В 1913 году на заводе BASF в городе Оппау (ныне район в городе Людвигсхафен-на-Рейне) была запущена первая в мире промышленная установка синтеза аммиака, а в 1918 году Фриц Габер стал лауреатом Нобелевской премии по химии.

Фриц Габер (фото: st.hi-it.spb.ru)
Интересно, что позднее Габер, наоборот, был чуть ли не предан анафеме международным научным сообществом из-за своего сотрудничества с военной промышленностью Германии во время Первой мировой войны: согласно некоторым источникам, Габер якобы лично координировал первую в истории газовую атаку в районе города Ипр 22 апреля 1915 года.
В СССР первая партия синтетического аммиака была получена только в 1928 году на Чернореченском химическом комбинате.
Современное производство
В современной промышленности аммиак добывают из азота и водорода методом синтеза Габера-Боша. Для этого смесь газов в соотношении 1:3 подвергают сжатию под высоким давлением и подают в контактную печь (камеру синтеза), где при температуре 400—500 °С, давлении и в присутствии катализаторов (железа с добавками оксидов алюминия и калия) происходит синтез аммиака:
N2 + 3H2 = 2NH3
Газовая смесь, состоящая из непрореагировавших веществ и продуктов реакции (азот, водород, аммиак) после контакта с катализатором охлаждается в теплообменнике, отдавая тепло входящим газам, а затем поступает в холодильник.
Охлаждение производится водой, движущейся противотоком – это приводит к конденсации аммиака. После чего новоиспеченный жидкий аммиак направляется в сепаратор, где полезный продукт отделяется от непрореагировавших газов, которые циркуляционный компрессор возвращает в колонну синтеза.
Многократная циркуляция газов позволяет увечить выход продукта и снижает производственные издержки.
В настоящее время в мире производится около 200 млн. тонн аммиака, причем десятая часть этого объема приходится на Россию (на экспорт из нашей страны уходит 4,-4,5 млн. тонн продукта).

Завод «Тольттизазот» - крупнейший российский производитель аммиака
Основная часть производимого промышленностью жидкого аммиака идет на производство азотных удобрений – нитрата и сульфат аммония, мочевины (карбамида), аммиачной воды и др.
Главной особенностью аммиачных удобрений является то, что они содержат азот в аммонийной форме и при этом хорошо растворяются в воде – в таком виде азот быстро усваивается растениями, что положительно сказывается на приросте биомассы и в конечном счете на урожайности сельхозкультур.
Аммиак также используют для производства взрывчатых веществ, некоторых видов полимеров, азотной кислоты, соды (по аммиачному методу) и некоторых других продуктов химпрома. Жидкий аммиак также используют в качестве растворителя и в качестве агента холода в промышленных холодильных установках.
Натуральный токсикант
При всей своей натуральности и широком распространении в живой природе, аммиак - все-таки высокотоксичное вещество, которое даже в малых дозах может привести к тяжелому отправлению.
По физиологическому действию на организм аммиак относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отек легких и тяжелое поражение нервной системы.
Пары аммиака способны сильно раздражать слизистые оболочки глаз и органов дыхания, а также кожные покровы, вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи.
При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями.
А поскольку сжиженный аммиак при испарении еще и поглощает тепло, то при его соприкосновении с поверхностью тела может произойти обморожение различной степени тяжести.
Предельно допустимая концентрация паров аммиака в воздухе рабочей зоны производственного помещения составляет 20 мг/м³. В атмосферном воздухе населённых пунктов и в жилых помещениях среднесуточная предельно допустимая концентрация аммиака (ПДК) не должна превышать 0,04 мг/м³. Максимальная разовая концентрация в атмосфере — 0,2 мг/м³.
Эти концентрации считаются безопасными для здоровья человека. Но что если нормативы не соблюдаются или происходят аварии с выбросами аммиака?
При концентрациях аммиака в 40-80 г/м³ в воздухе жилой зоны или предприятия уже могут наблюдаться различные патологические проявления у всех, кто дышит таким воздухом: раздражаются верхние дыхательные пути и слизистые оболочки, наблюдаются головная боль и головокружение.
При содержании аммиака в воздухе в концентрации 280 мг/м³ происходит раздражение зева и гортани, при 490 мг/м³ - сильное раздражение глаз.
При действии в очень высоких концентрациях аммиак вызывает поражение кожи: при 7-14 г/м³ — эритематозный, при 21 г/м³ и более — буллезный дерматит.
Токсический отек легких развивается при воздействии аммиака на организм в течение часа с концентрацией 1,5 г/м³ (такая концентрация уже считается смертельной). А даже кратковременное воздействие аммиака в концентрации 3,5 г/м³ и более моментально приводит к развитию общетоксических эффектов и смерти.
Проблема в том, что запах аммиака начинает ощущается при концентрации примерно 37-40 мг/м³, а это уже, как мы видим, близко к порогу, при котором уже происходит легкое отравление: вот почему утечки аммиака на промышленных установках или при транспортировки невозможно отслеживать, полагаясь только на обоняние.
Поэтому на производстве необходимо постоянно мониторить состояние воздуха. Для этих целей обычно используются аспираторы с индикаторными трубками на аммиак или газоанализаторы.
Аварии на производстве
Несмотря на все предосторожности при обращении с аммиаком, аварии с выбросами этого вещества происходят с завидной регулярностью.
Чаще всего имеют место различные инциденты на производствах с аммиачными холодильными установками. Из-за износа оборудования истощаются, рассыпаются герметизирующие прокладки, отрываются вентили и т.п.
Либо же имеет место человеческий фактор: из-за оплошности повредили трубопровод, вовремя не сбросили давление и т.п. Показательный случай такого рода - инцидент с отравлением 60 человек в ледовом дворце в городе Штраубинге в Баварии. Из-за того, что задействованный на ремонтных работах экскаватор повредил одну из труб системы охлаждения искусственного льда, пришлось оказывать медицинскую помощь посетителям катка, а более 70 местных жителей и 118 учеников местной школы пришлось срочно эвакуировать.
Успевшие надышаться «ледовым» аммиаком люди жаловались на раздражение глаз, дыхательных путей, кашель.
В 2018 году четверо рабочих птицефабрики «Моссельпром» получили экстремально высокие дозы паров аммиака, двое из них скончались в больнице.
Забавно, но утечки аммиака иногда происходят даже в космосе. В 2015 году случилась авария в американском сегменте Международной космической станции: из системы охлаждения стал утекать аммиак. Астронавтам пришлось укрыться в российском сегменте станции.
Одна из крупнейших из известных «аммиачных» катастроф произошла незадолго до распада Советского Союза. Речь о событиях 20 марта 1989 года в Литовской ССР на заводе «Азот». Тогда разорвалась емкость с жидким аммиаком объемом 7 тыс. тонн.
Вещество обильно разлилось по территории завода и загорелось от факела дожигания на компрессорной установке. Огонь охватил цех производства минеральных удобрений и склад готовой продукции.
Помимо пожарной службы, для ликвидации огня была прислана военная техника. Из соседних регионов прибыли насосные станции, пожарные трое суток беспрерывно заливали водой горящее аммиачное «озеро».
К вечеру 20 марта усилился ветер, а на следующий день было зафиксировано токсичное облако размером 7 на 50 км между городами Ионава и Кедайняй.
Было принято решение полностью эвакуировать город Ионава. Людей вывозили автобусами в ближайшие пионерские лагеря и санатории.
Одновременно с тушением пожара пришлось принимать меры по недопущению утечек жидкого аммиака в водоемы. Была перекрыта ливневая система, вода из нее откачивалась и собиралась в емкости. За три дня было собрано 20 тыс. кубометров зараженных вод. Эта мера позволила избежать масштабного загрязнения реки Нярис.
Однако концентрация аммония в деревне Упнинкай, в 10 километрах от завода, все же превысила предельно допустимые значения в 150 раз.
В результате аварии в итоге погибло 5 человек и пострадало 57. Один из пострадавших позже скончался в больнице. Также погиб пожарный.
29 человек стали инвалидами, многие получили острую респираторную и сердечную аритмию.
Крупная техногенная авария произошла в 2013 году в городе Горловка (Украина, Донецкая область). Во время ремонтных работ на местном заводе в межцеховом аммиачном коллекторе на заводе «Сторол» произошла разгерметизация трубопровода. Произошел выброс, в результате которого над заводом поднялось ядовитое облако.
Всего в воздух тогда попало 600 килограммов аммиака. На заводе началась неразбериха и паника, противогазов на всех не хватило.
Погибло 6 человек, в больницы с отравлениями различной степени тяжести попало больше 50 сотрудников предприятия и случайных прохожих.
Ситуацию усугубило то, что жителей Горловки не успели вовремя оповестить об аварии: люди сами, почуяв химический запах, спешили покинуть улицу. Но успели, как видно, не все…
Лишь когда удалось локализовать утечку, Управление гражданской защиты Горловского горсовета распространило сообщение об инциденте: мол, угрозы для жизни и здоровья нет.
Интересно, что и России случались аварии на той же ветке аммиакопровода, которой запитывался завод завод «Сторол». В 2015 году в Воронежской области на одном из участков аммиакопровода Тольятти-Одесса произошла разгерметизация. Пришлось срочно эвакуировать жителей ближайшего поселка - больше 700 человек. Но несколько человек пришлось, все же, госпитализировать с различной степенью интоксикации.

Ликвидация утечки на аммиакопроводе Тольятти-Одесса. Воронежская область, 2015 год
Безусловно, несмотря на все риски, отказываться от производства аммиака никто не будет: этому продукту просто нет альтернативы – в частности, как компонента эффективных и недорогих азотных удобрений, спрос на которые в обозримой перспективе будет только расти, учитывая рост населения планеты и потребности в увеличении производства еды.
Но с другой стороны, невозможно не учитывать негативный опыт многочисленных инцидентов с человеческими жертвами. Очевидно, что размещать аммиачные производства в населенных пунктах или даже в опасной близости от них просто недопустимо. То же самое касается железнодорожных и портовых терминалов по перевалке жидкого аммиака.
А на самих производственных и транспортных объектах необходим усиленный контроль за состоянием оборудования и его герметичности.
Разумеется, должен вестись и постоянный мониторинг качества воздуха - как на самом промышленном объекте, так и на границе санитарно-защитной зоны: местные жители должны иметь доступ к этой информации, а власти должны иметь отработанный план действий на случай ЧП.
 Подписка на рассылку
Подписка на рассылку
